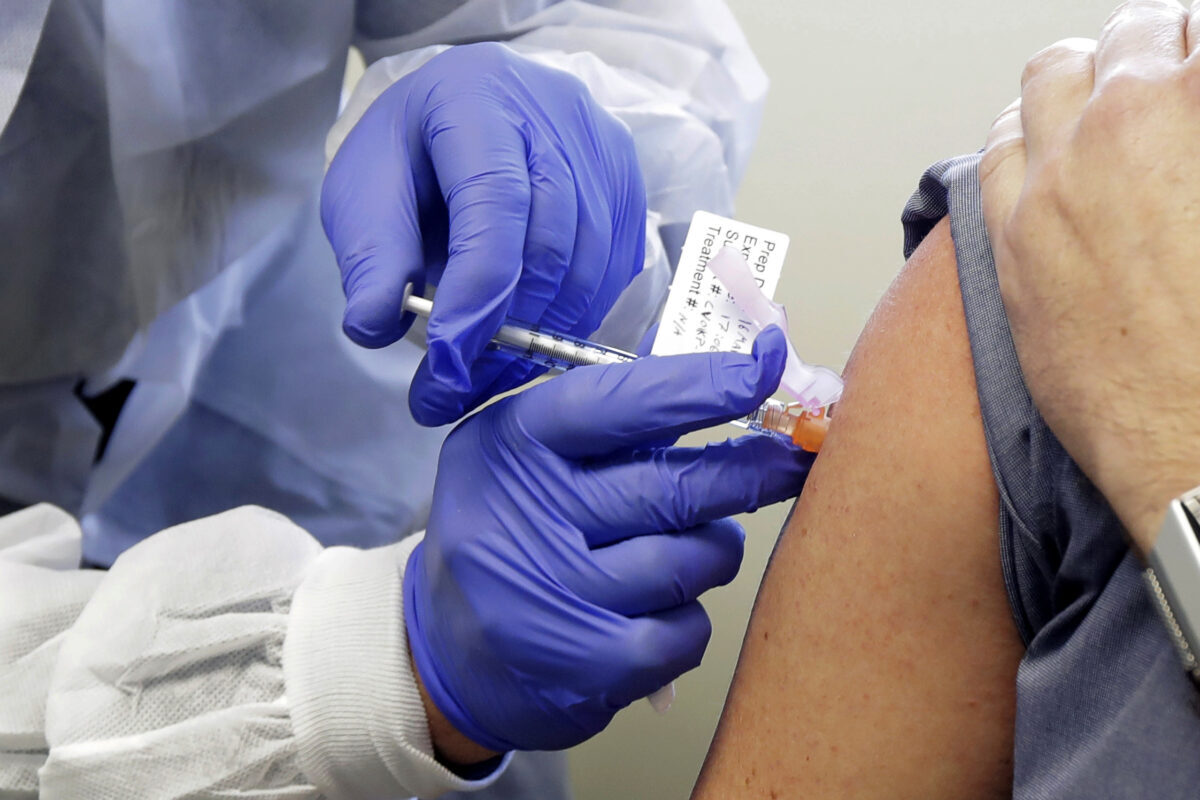
FDA phê duyệt vắc-xin COVID-19 của Pfizer để sử dụng khẩn cấp

Cơ quan Quản lý Thực phẩm và Dược phẩm của Hoa Kỳ (FDA) cho biết hôm thứ Sáu (11/12) rằng họ đang làm việc nhanh chóng để hoàn thiện việc phê duyệt cho phép sử dụng khẩn cấp vắc-xin Pfizer-BioNTech COVID-19.
Trong một tuyên bố chung, Ủy viên FDA, ông Stephen M. Hahn và Giám đốc Trung tâm Nghiên cứu và Đánh giá Sinh học (CBER), ông Peter Marks, cho biết cơ quan này đã thông báo cho Pfizer-BioNTech “rằng họ sẽ nhanh chóng làm việc để hoàn thiện và ban hành quyền sử dụng khẩn cấp.”
Hai ông cũng cho biết FDA đã thông báo cho Trung tâm Kiểm soát và Phòng ngừa Dịch bệnh (CDC) và Chiến dịch Hành động Khẩn cấp của chính quyền TT Trump về việc vắc-xin sắp được phê duyệt cho việc sử dụng khẩn cấp để có thể chuẩn bị cho việc phân phối kịp thời.
Chính phủ Hoa Kỳ đã cam kết phân phối 2.9 triệu liều vắc-xin cho công chúng trong vòng 24 giờ sau khi FDA phê duyệt.
Bộ trưởng Y tế và Dịch vụ Nhân sinh, ông Alex Azar nói với chương trình “Chào buổi sáng Hoa Kỳ” của đài ABC vào sáng thứ Sáu rằng, “Chúng ta có thể thấy mọi người tiêm chủng vào thứ Hai, thứ Ba của tuần tới”.
Ông Azar nói: “Trong vài ngày tới, có thể là khi chúng tôi đàm phán với Pfizer về thông tin mà bác sĩ cần để kê đơn phù hợp, chúng ta sẽ thấy việc cấp phép cho loại vắc-xin đầu tiên này.”
Thông báo của FDA và nhận xét của ông Azar theo sau cuộc bỏ phiếu hôm thứ Năm của một hội đồng có 23 thành viên gồm các cố vấn y tế độc lập để ủng hộ vắc-xin dùng trong trường hợp khẩn cấp, sau khi thảo luận về việc liệu bằng chứng khoa học có ủng hộ quan điểm rằng sản phẩm có tên BNT162b2 có hiệu quả trong việc ngăn ngừa COVID-19 ở những người từ 16 tuổi trở lên hay không, và liệu những lợi ích đã biết có lớn hơn những nguy cơ tiềm ẩn.
Tiến sĩ Albert Bourla, Chủ tịch và là Giám đốc Điều hành (CEO) của hãng dược Pfizer, cho biết trong một tuyên bố hoan nghênh cuộc bỏ phiếu của ban Hội thẩm: “Chúng tôi hài lòng với đa số phiếu ủng hộ mạnh mẽ của Ủy ban và nếu FDA cấp phép, hãy sẵn sàng mang vắc-xin này đến người dân ở Hoa Kỳ trong nỗ lực giúp chống lại đại dịch tàn khốc này.”
“Tôi muốn cảm ơn Ủy ban cố vấn của FDA đã nhận ra vai trò quan trọng mà vắc-xin của chúng tôi có thể đóng góp vào việc giúp giải quyết đại dịch đang diễn ra này. Cuộc thảo luận và bỏ phiếu tích cực ngày hôm nay củng cố tiềm năng của ứng cử viên vắc-xin COVID-19 của chúng tôi trong việc giúp bảo vệ mọi người chống lại căn bệnh chết người và tàn khốc này,” ông Ugur Sahin, CEO và đồng sáng lập hãng dược BioNTech, cho biết trong một tuyên bố.
Vắc-xin này nhằm mục đích miễn dịch chống lại COVID-19, là bệnh có triệu chứng do virus SARS-CoV-2 gây ra. Phác đồ [điều trị] có thể là cho các cá nhân nhận hai liều, được tiêm cách nhau 21 ngày.
Trước cuộc thảo luận của hội đồng về tính an toàn và hiệu quả của vắc-xin, FDA đã đưa ra một phân tích chi tiết kết luận rằng vắc-xin Pfizer-BioNTech “đáp ứng các tiêu chí thành công theo quy định.”
Pfizer và BioNTech cho biết vắc-xin của họ đã chứng minh được tỷ lệ hiệu quả là 95%, mà không có lo ngại nghiêm trọng về an toàn.
Về vấn đề an toàn, FDA đã xem xét dữ liệu từ khoảng 38,000 người tham gia từ 16 tuổi trở lên và nhận thấy “một hồ sơ an toàn thuận lợi, không có mối lo ngại cụ thể nào về an toàn được xác định sẽ ngăn cản việc cấp phép EUA [cho phép sử dụng khẩn cấp],” theo phân tích.
Tuy nhiên, nghiên cứu đã lưu ý rằng “hiện không có đủ dữ liệu để đưa ra kết luận về tính an toàn của vắc-xin đối với các nhóm dân số nhỏ như trẻ em dưới 16 tuổi, phụ nữ mang thai và phụ nữ cho con bú và người bị suy giảm miễn dịch”.
Những người tham gia nghiên cứu đã gặp một số tác dụng phụ sau khi dùng vắc-xin mà FDA đã lưu ý, phổ biến nhất là phản ứng tại chỗ tiêm (84.1%), mệt mỏi (62.9%), đau đầu (55.1%), đau cơ ( 38.3%), ớn lạnh (31.9%), đau khớp (23.6%) và sốt (14.2%).
FDA cũng phát hành bản phân tích riêng của Pfizer và BioNTech về tính hiệu quả và an toàn của vắc-xin, trong đó chỉ ra rằng dữ liệu “không cho thấy bất kỳ mối lo ngại nghiêm trọng nào về an toàn” và phản ánh phân tích của FDA về mức độ hiệu quả của sản phẩm của họ trong việc ngăn ngừa nhiễm COVID-19.
Những công ty này là công ty đầu tiên xin phê duyệt khẩn cấp cho vắc-xin COVID-19. Ứng cử viên của Moderna, có tên là mRNA-1273, được FDA lên lịch xem xét vào ngày 17/12.

 Mới nhất
Mới nhất
 Tiêu điểm
Tiêu điểm
 Bình luận
Bình luận
 Email
Email