FDA chấp thuận thuốc điều trị Covid-19 đầu tiên tại Mỹ

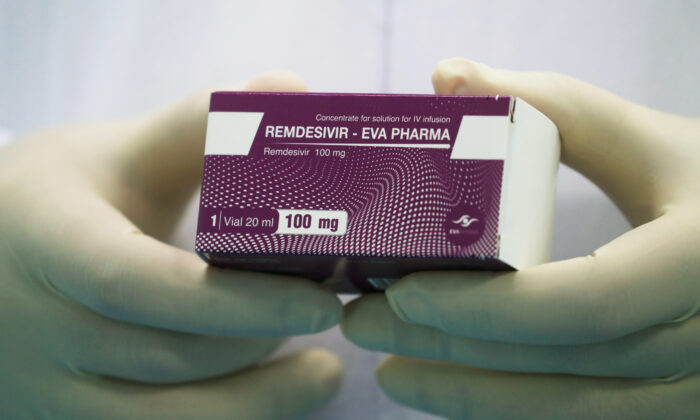
Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ hôm thứ Năm (22/10) đã chấp thuận thuốc kháng virus Remdesivir của Gilead Sciences để điều trị cho người lớn nhiễm COVID-19. Đây là loại thuốc điều trị bệnh viêm phổi Vũ Hán đầu tiên và duy nhất được FDA chấp thuận ở Hoa Kỳ.
Gilead Sciences đã đặt tên cho phiên bản Remdesivir của mình là “Veklury.” Thuốc được sử dụng để tiêm vào tĩnh mạch của bệnh nhân.
FDA thông báo: “Veklury chỉ nên được sử dụng ở bệnh viện hoặc tại cơ sở chăm sóc sức khỏe có đủ năng lực cung cấp dịch vụ chăm sóc nhanh chóng tương đương với chăm sóc nội trú tại bệnh viện”. FDA cũng lưu ý rằng thuốc đang được chính thức chấp thuận (không chỉ cấp giấy phép sử dụng khẩn cấp) để sử dụng cho bệnh nhân từ 12 tuổi với cân nặng từ 40 kg trở lên.
Hôm thứ Năm, FDA cũng đã ban hành giấy phép sử dụng khẩn cấp mới (EUA) cho Remdesivir để điều trị bệnh nhi dưới 12 tuổi nhập viện có cân nặng từ 3,5 kg; đối tượng này đã đủ tiêu chuẩn để được tiêm vào tĩnh mạch.
Thực tế, Velukry đã được cung cấp sử dụng theo giấy phép EUA của FDA từ tháng 5, sau khi một nghiên cứu (thử nghiệm ACTT-1) do Viện Dị ứng và Bệnh truyền nhiễm Quốc gia (NIAID) tài trợ chứng minh rằng thuốc giúp giảm thời gian nằm viện 5 ngày so với mức trung bình 15 ngày.
Ủy viên FDA Stephen Hahn cho biết trong một tuyên bố: “Đối diện với tình huống khẩn cấp về sức khoẻ chưa từng có tiền lệ này, FDA cam kết thúc đẩy sự phát triển và khả năng cung ứng của các phương pháp điều trị COVID-19. Là một phần của Chương trình Tăng tốc Điều trị Coronavirus của FDA, cơ quan này sẽ tiếp tục hỗ trợ chuyển các sản phẩm y tế mới đến bệnh nhân càng sớm càng tốt, đồng thời xác định xem chúng có hiệu quả hay không và lợi ích của chúng có lớn hơn rủi ro hay không.”
Hôm thứ Năm, FDA cho biết họ đã chấp thuận Veklury sau khi phân tích dữ liệu từ ba thử nghiệm lâm sàng ngẫu nhiên, có đối chứng trên những bệnh nhân nhập viện với COVID-19 từ nhẹ đến nặng. Một trong ba nghiên cứu là thử nghiệm ACTT-1 do NIAID tài trợ, trong khi hai nghiên cứu khác được Gilead tài trợ.
Tổ chức Y tế Thế giới (WHO) hôm 15/10 thông báo rằng họ đã thử nghiệm nhiều phác đồ điều trị COVID-19 và thấy Remdesivir không có tác động đáng kể đối với thời gian nằm viện hoặc khả năng sống sót của bệnh nhân. Tuy nhiên, nghiên cứu đó chưa được bình duyệt.
Gilead đã đặt câu hỏi về sự thiếu tính khách quan trong nghiên cứu của WHO, do bệnh nhân và bác sĩ của họ đều biết họ đang sử dụng phương pháp điều trị nào. Công ty Gilead phát biểu với Financial Times hôm 15/10: “Phát hiện mới có vẻ không nhất quán với các bằng chứng vững chắc hơn từ nhiều nghiên cứu ngẫu nhiên, có đối chứng đã xác nhận lợi ích lâm sàng của Remdesivir. Chúng tôi lo ngại dữ liệu từ thử nghiệm toàn cầu nhãn mở này không trải qua quá trình đánh giá nghiêm ngặt cần thiết để cho phép thảo luận khoa học mang tính xây dựng, đặc biệt là do những hạn chế của thiết kế thử nghiệm.”
Ông Merdad Parsey – Giám đốc Y tế của Gilead khẳng định Remdesivir là “phương pháp điều trị kháng virus đầu tiên được chứng minh có khả năng giúp bệnh nhân mắc COVID-19 hồi phục nhanh hơn”.
Ông nói: “Trong vòng chưa đầy một năm, thế giới đã đi từ cảm giác tuyệt vọng khi cố gắng hiểu một căn bệnh chưa chưa từng có đang lây lan nhanh chóng và cướp đi sinh mạng con người, sang hy vọng rằng giờ đây chúng ta có đủ kiến thức và công cụ để chống lại COVID-19. Với sự chấp thuận của FDA và sự cho phép theo quy định hay đồng ý tạm thời của khoảng 50 quốc gia khác trên thế giới, Veklury (Remdesivir) là một trong những công cụ hữu ích ngày nay.”
Ông Parsey nói rằng nghiên cứu của WHO “cung cấp thông tin về Veklury trong điều kiện thực tế ở những ngày đầu của đại dịch,” nhưng “không phủ nhận các kết quả nghiên cứu khác — đặc biệt là từ một thử nghiệm được thiết kế với các tiêu chuẩn khoa học khắt khe nhất, như trường hợp của ACTT-1. ”
Gilead tính phí cho một khóa điều trị 5 ngày thông thường trong các chương trình y tế của chính phủ Mỹ và các nước phát triển khác là 2.340 đô la Mỹ và 3.120 đô la Mỹ cho cùng một liệu trình đối với các công ty bảo hiểm tư nhân. Số tiền mà bệnh nhân phải tự chi trả phụ thuộc vào loại bảo hiểm, mức thu nhập và các yếu tố khác.
Tổng thống Donald Trump đã được điều trị bằng Remdesivir vào đầu tháng này khi ông nhiễm COVID-19. Ông cũng được điều trị theo các phương pháp khác bao gồm phương pháp điều trị bằng hỗn hợp kháng thể thử nghiệm của Regeneron Pharmaceuticals Inc. Tổng thống Trump cũng sử dụng các loại thuốc và chất bổ sung khác vào thời điểm đó, bao gồm “kẽm, vitamin D, famotidine, melatonin và aspirin hàng ngày”.
Cho đến nay, chỉ có steroid như dexamethasone được chứng minh là làm giảm nguy cơ tử vong do COVID-19. FDA cũng đã cấp giấy phép EUA cho việc sử dụng máu của những người khỏi bệnh (hay còn gọi là huyết tương dưỡng bệnh), và có hai công ty hiện đang xin cấp phép khẩn cấp tương tự cho các loại thuốc kháng thể thử nghiệm.
Isabel van Brugen, Reuters, và The Associated Press đã đóng góp vào bài báo này.

 Mới nhất
Mới nhất
 Tiêu điểm
Tiêu điểm
 Bình luận
Bình luận
 Email
Email