Vì sao hơn 50% người Mỹ không muốn tiêm vaccine ngừa Covid-19?

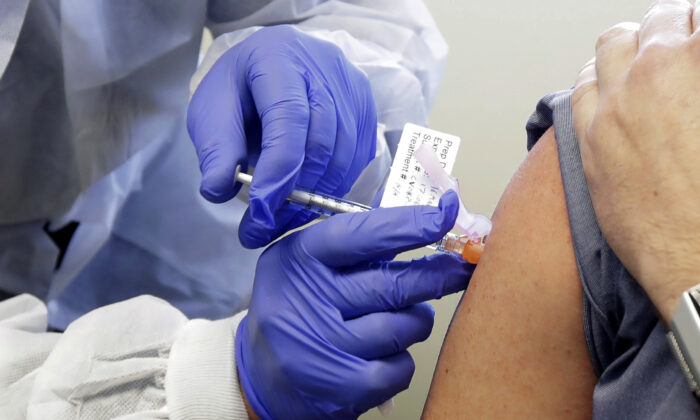
Vaccine ngừa virus corona đầu tiên sẽ hoàn thành thử nghiệm giai đoạn 3 vào cuối tháng 10, nhưng gần một nửa số người Mỹ nói rằng họ sẽ không tiêm vaccine này.
Trong một cuộc thăm dò gần đây của Trung tâm Nghiên cứu Pew về việc liệu người Mỹ có sẵn sàng tiêm vaccine ngừa virus Vũ Hán (hay còn gọi là virus CCP) hay không, chỉ 51% cho biết họ sẽ tiêm, giảm 21% so với cuộc thăm dò hồi tháng Năm. 49% còn lại nêu lý do họ không tiêm là vì quan ngại về các tác dụng phụ tiềm ẩn của nó.
Nhờ Chiến dịch Warp Speed mà vaccine ngừa virus CCP đã được phát triển với một tốc độ chóng mặt. Chính quyền của TT Trump đã gây dựng chuỗi đối tác khắng khít từ khâu sản xuất, phát triển và phân phối vắc xin COVID-19 đến chẩn đoán và điều trị bệnh viêm phổi Vũ Hán.
Mặc dù nhiều người đang trông chờ một loại vaccine có thể chấm dứt đại dịch, nhưng tốc độ phát triển vaccine quá nhanh đã làm dấy lên sự lo ngại về tính an toàn và tác dụng lâu dài của nó
Học sinh trung học Sam Leong vừa cập nhật lại tình trạng chủng ngừa của mình, nói rằng cô ấy sẽ không tiêm vaccine này do “thử nghiệm hạn chế” và lo ngại về tính an toàn của nó. “Làm sao chúng ta thực sự biết được liệu vaccine có hoạt động hay không? Nó không bảo vệ bạn 100% khỏi viêm phổi Vũ Hán”, Leong nói với The Epoch Times trong một email.
Leong, một học sinh lớp 12, cho biết cô cũng lo ngại về sự thiếu minh bạch của nhà sản xuất, công bố “thử nghiệm vaccine của Vương quốc Anh [đã bị] dừng” và sau đó được tiếp tục mà không có lời giải thích rõ ràng. “Họ không đưa ra lý do tại sao và đã tiếp tục thử nghiệm,” Leong nói. “Không có sự minh bạch.”
Tại Vương quốc Anh, công ty đa quốc gia AstraZeneca đang dẫn đầu nghiên cứu về vaccine ngừa virus Vũ Hán. Tại Hoa Kỳ, đó là cuộc đua giữa các ông lớn dược phẩm AstraZeneca, Moderna, Pfizer và Johnson & Johnson (J&J) trong việc cung cấp loại vaccine này.
AstraZeneca đã tạm dừng thử nghiệm trong vài ngày sau khi một người tham gia bị nghi ngờ mắc bệnh viêm tủy cắt ngang, một chứng rối loạn thần kinh gây viêm cả hai bên tủy sống. Các triệu chứng bao gồm yếu cơ hoặc liệt, đau và giảm cảm giác với ánh sáng, xúc giác và nhiệt độ. Không có cách điều trị rối loạn này và trong nhiều trường hợp không xác định được nguyên nhân gây ra rối loạn này.
Sau khi công bố việc này, thử nghiệm lâm sàng của AstraZeneca tại Hoa Kỳ tiếp tục được thực hiện. FDA được cho là đang điều tra về các tác dụng phụ nghiêm trọng xuất hiện trong các thử nghiệm vaccine tương tự trước đó được phát triển bởi đối tác của công ty, Đại học Oxford..
Thử nghiệm lâm sàng đầu tiên của Moderna với 45 người, thì 3 trong số những người tham gia vào nhóm sử dụng liều cao đều trải qua phản ứng có hại toàn thân “mức độ 3” đối với thuốc chủng ngừa và một người ở nhóm liều thấp nhất bị nổi mề đay thoáng qua (phát ban).
Theo FDA, tác dụng phụ mức độ 3 là “nghiêm trọng hoặc có ý nghĩa về mặt y tế nhưng không đe dọa tính mạng ngay lập tức; chỉ định nhập viện hoặc kéo dài thời gian nằm viện; mất khả năng; hạn chế các hoạt động tự chăm sóc bản thân trong cuộc sống hàng ngày.”
“Chúng tôi không có cách nào để biết ai sẽ bị phản ứng và bạn sẽ không được bồi thường về mặt tài chính”, Pam Long, Nhân viên tình báo y tế của Lực lượng gìn giữ hòa bình NATO và người phát ngôn của Liên minh Lựa chọn Y tế Colorado, nói với The Epoch Times. “Ở Hoa Kỳ không có trách nhiệm pháp lý nào đối với vaccine, nhà sản xuất và bác sĩ chỉ định sử dụng chúng”.
Quốc hội đã thông qua Đạo luật Bồi thường Thương tật do vaccine vào năm 1986, cho phép các nhà sản xuất vaccine và những nhà cung cấp vaccine miễn trừ khỏi các vụ kiện bởi cha mẹ của một đứa trẻ bị tổn thương do vaccine. Thay vào đó, phụ huynh phải nộp đơn yêu cầu chính phủ liên bang theo Chương trình Bồi thường Thương tật vaccine Quốc gia. Yêu cầu bồi thường chỉ có thể được nộp cho các tổn thương nghiêm trọng được liệt kê trong bảng.
Chương trình bồi thường thương tật cho các biện pháp ứng phó khẩn cấp
Vaccine, thuốc và các biện pháp ứng phó khẩn cấp khác được cấp phép khẩn cấp cũng được miễn trừ các vụ kiện. Năm 2005, Quốc hội đã thông qua Đạo luật Công Sẵn sàng và Chuẩn bị Khẩn cấp (PREP) cho phép Bộ trưởng Bộ Y tế và Dịch vụ Nhân sinh ban hành tuyên bố Đạo luật PREP, trao quyền miễn trừ trách nhiệm cho “các thực thể và cá nhân liên quan đến phát triển, sản xuất, thử nghiệm, phân phối, quản lý và sử dụng các biện pháp ứng phó như vậy.”
Các biện pháp ứng phó được đề cập bao gồm (1) thuốc, sản phẩm sinh học hoặc thiết bị được phép sử dụng trong điều tra hoặc sử dụng khẩn cấp, (2) “các sản phẩm cung cấp cho đại dịch hoặc dịch bệnh đủ tiêu chuẩn” hoặc (3) “các biện pháp đối phó an ninh”.
Những người bị tổn thương hoặc tử vong do “vaccine được cấp phép khẩn cấp”chỉ có một năm để nộp đơn yêu cầu và chứng minh thương tích của họ theo Chương trình Bồi thường Thương tật cho các biện pháp ứng phó, một chương trình của chính phủ liên bang được thành lập dựa trên Đạo luật PREP.
Tuyên bố Đạo luật PREP cho COVID-19 có hiệu lực vào ngày 4 tháng 2 năm 2020.
Hydroxychloroquine
Vẫn chưa có loại thuốc nào được FDA chấp thuận để điều trị COVID-19, nhưng nhiều loại thuốc đang được thử nghiệm, bao gồm cả hydroxychloroquine “gây tranh cãi và bị chính trị hóa”. Các nhà nghiên cứu trên khắp thế giới đang tiếp tục xem xét liều lượng, cách sử dụng kết hợp với các loại thuốc khác và thời gian điều trị của thuốc này.
“Hiện đã có hơn 80 nghiên cứu cho thấy rằng việc sử dụng hydroxychloroquine dự phòng (trước nhiễm trùng) ngăn ngừa hoặc làm giảm đáng kể mức độ nghiêm trọng của COVID-19,” TS.BS. Simone Gold, người sáng lập Frontline Doctors – Bác sĩ tuyến đầu – nói với The Epoch Times trong một email. “Tất cả các nghiên cứu không cho thấy lợi ích của việc sử dụng hydroxychloroquine đều có một trong ba sai sót sau: thuốc được sử dụng muộn khi mắc bệnh (nhập viện), hoặc với liều lượng quá cao, hoặc không kết hợp với kẽm.”
Gold nói rằng kẽm thực sự là thứ “ngăn chặn sự nhân lên của virus” và hydroxychloroquine “tương tác hiệp đồng với kẽm”.
Một trong những lý do chính khiến thuốc được tuyên bố là “không hiệu quả” và cũng là lý do Tổ chức Y tế Thế giới tạm thời ngừng các nghiên cứu về hydroxychloroquine trên khắp thế giới là do một nghiên cứu lớn do Surgisphere Corporation tiến hành, đã tuyên bố “hydroxychloroquine hoặc chloroquine (kết hợp hoặc không kết hợp với kháng sinh nhóm macrolide) không có bằng chứng mang lại lợi ích trong điều trị cúm Vũ Hán, ngược lại, có liên quan đến sự gia tăng nguy cơ loạn nhịp thất và nguy cơ tử vong trong bệnh viện do COVID-19. ”
Nghiên cứu này được xuất bản trên một trong những tạp chí y khoa uy tín nhất, The Lancet, đã bị rút lại hai tuần sau đó vào ngày 5 tháng 6, sau khi bên bình duyệt thứ ba độc lập bị từ chối truy cập vào dữ liệu thô để “sao chép các phân tích được trình bày trong bài báo.”
Surgisphere sau đó đã đóng trang web cùng với các tài khoản mạng xã hội của họ vào ngày 15 tháng 6.
Trước đại dịch, hydroxychloroquine đã được sử dụng an toàn trên khắp thế giới ở mọi lứa tuổi, bao gồm cả phụ nữ mang thai và bệnh nhân bị suy giảm miễn dịch. Thuốc đã được FDA chấp thuận trong hơn 65 năm đối với bệnh sốt rét, viêm khớp dạng thấp và lupus.
“Kể từ khi nó ra đời cách đây 70 năm vào năm 1955, hàng triệu bệnh nhân đã sử dụng thuốc này,” Tiến sĩ Daniel Wallace, một bác sĩ chuyên khoa thấp khớp nổi tiếng và Phó Giám đốc Khoa Thấp khớp Trung tâm Y tế Cedars Sinai cho biết trong một cuộc phỏng vấn với Tiến sĩ Mehmet Oz vào tháng Tư. “Chưa có bất kỳ trường hợp tử vong nào được báo cáo do sử dụng thuốc này dưới dạng đơn trị liệu nghĩa là chỉ uống mỗi loại thuốc đó”
Về sự lo ngại hydroxychloroquine có thể gây ra các vấn đề về tim, Wallace, người có 42 năm kinh nghiệm thực hành lâm sàng cho biết, “Đó là vấn đề với chloroquine, người anh em họ đầu tiên của nó, và đó là vấn đề với hydroxychloroquine vào những năm 1950 và 60 khi các bác sĩ sử dụng gấp hai đến ba lần liều thông thường. Trong liều khuyến cáo hiện tại [400 mg], các vấn đề về tim mạch thực sự không xảy ra ”.
Theo Zion Market Research, thị trường vắc xin toàn cầu trị giá 41,7 tỷ đô la vào năm 2019 và dự kiến sẽ “đạt hơn 69,8 tỷ đô la vào năm 2026” do “sự gia tăng các bệnh truyền nhiễm”.